
热门搜索:
上海角宿企业管理咨询有限公司主要提供FDA510(K)、N95认证、TGA注册、欧代注册、自由销售证明、MDR认证,ISO13485体系认证咨询等服务,公司注重规范化内部管理体系建立,在外部对接、内部工作流程、服务后追溯等工作区块,具备良好的策划、评估、监测能力,上海角宿注重企业信用体系建立,全力贯彻商业契约精神。欢迎来电咨询!
FDA 美国代理人做是什么的?
在美国分销设备的美国境外医疗器械公司都必须有 FDA 美国代理人。这包括美国以外的制造商、合同制造商和规格开发商。美国代理人协助FDA与设备公司进行沟通,最常见的沟通涉及有关出口到美国的设备和安排 FDA 检查的问题。美国代理人的角色与欧洲授权代表、英国负责人或瑞士授权代表非常相似。与 EC 代表不同,设备标签中不包括美国代理商。美国代理人的姓名和联系信息仅出现在FDA 网站上的FDA 机构注册记录中。
美国代理需要什么认证或合同吗?
FDA美国代理人没有认证程序,但您应该与您的代理人有正式签署的协议或合同。我**见过 FDA 要求提供合同副本或美国代理人或注册公司的信件。但是,由于代理人具有法律角色和责任,因此您应该确保协议或合同到位。美国代理人不需要是法人实体,但您需要输入“公司名称”。没有地方可以输入 EIN,DUNS 号码是可选的。下面是帐户创建表单的屏幕截图。
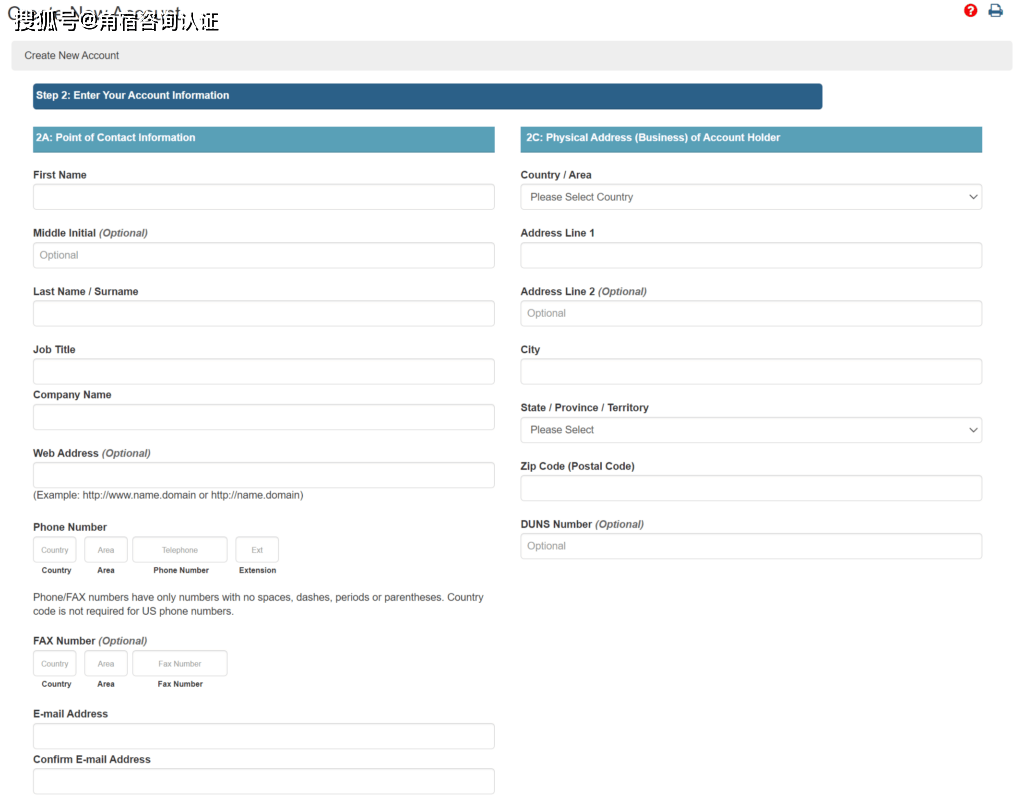
您还应该考虑将您的代理添加到您的批准供应商列表(即 LST-003)中。如果您还没有供应商质量管理程序(即 SYS-011),医疗器械学院有一个可供购买的程序,其中包括用于审查和批准新供应商的模板(即 FRM-005)和一个模板获取批准的供应商列表(即 LST-003)。FDA 美国代理人不需要质量体系,但他们应该能够通过简历和/或培训记录证明美国 FDA 器械法规的能力。具体来说,能力应包括 21 CFR 820、803、806、830 和 807。将来,您的美国代理还必须具备 ISO 13485:2016 的能力。FDA 检查员应要求提供贵公司与美国代理商之间协议的证据。检查员还将在 FDA 检查期间审查您作为供应商的美国代理商的资格、批准和持续评估记录。理想情况下,您的代理人直接参与过之前的 FDA 检查,他们可以通过进行模拟 FDA 检查来为您做好准备。
FDA 采取哪些措施来确定美国代理商的资格?
FDA 很少对美国代理商的资格进行认证。FDA “做”的唯一一件事是,当您提交初始企业注册或更新 FDA 注册时,向 FDA 美国代理人发送一封自动电子邮件。电子邮件主题行是“需要采取行动:美国特工分配通知”。您的代理必须确保他们的电子邮件客户端已将此电子邮件识别为“安全发件人”,以防止电子邮件最终进入垃圾邮件文件夹。对于医疗器械,美国代理商*向 FDA 提交任何其他证明。
什么是“需要采取行动”电子邮件?
外国公司完成您的注册和列名后,FDA 立即向 FDA 美国代理人发送的“需要采取行动”电子邮件。
在您完成** FDA 企业注册或 FDA 企业注册续展后几秒钟,您的 FDA 美国代理人将收到一封来自 FDA 的自动电子邮件。然后,代理有十天的时间登录其 FURLS 帐户并确认他们愿意并且能够担任贵公司的美国代理。通知您的美国代理的电子邮件包含以下语言:
“如果您是该机构的美国代理人,请选择“是”,然后单击“提交”。如果您不是该机构的美国代理人,请选择“否”,然后单击“提交”。您必须在 10 个工作日内确认您是美国代理人。如果您未在10天内确认您是美国代理商,系统将自动取消您的收据代码并删除与国外机构相关的美国代理商信息。”
假设代理未在十个工作日内确认其角色。在这种情况下,FDA 将自动向您的公司发送电子邮件,告知代理人未确认其角色。如果您选择更可靠的美国代理人,则必须为同一人或新人重新提交请求。