医疗器械合规资料母版库建设指南:从散乱到体系化的实战蓝图
合规资料管理的痛点与价值
医疗器械企业常面临资料散落、版本混乱、审计响应慢的困境:测试报告在工程师本地硬盘、IFU在美工电脑、GSPR矩阵在注册人员邮箱……这不仅导致重复工作(平均每个产品注册浪费120工时),更在FDA、MDR等审计中造成严重风险。
本文提供一套可直接落地的母版库建设方法,涵盖顶层设计、命名规则、映射索引,并附上两周上线计划与SPICA角宿团队的合规支持方案。
一、母版库建设目标与管控红线
5个核心目标
可审计:任何文件15分钟内可检索
可追溯:需求→风险→验证→注册四向链接
可复用:跨产品模块化调用(如生物相容性报告)
可协作:多角色并行编辑(研发、RA、QA)
可对外:一键生成脱敏客户包
5条管控红线
❗ 不承诺“**”(母版库是工具,合规取决于内容质量)
❗ 不留“孤儿文件”(所有文件必须关联所有者)
❗ 不混草稿/正式版本(版本控制严格分离)
❗ 跨产品复用须评审(避免误用导致的合规风险)
❗ 不得泄露敏感信息(对外分发自动加水印+禁下载)
3种视图管理
| 视图类型 | 使用场景 | 示例路径 |
|---|---|---|
| 项目视图 | 按产品管理 | /20_Product/P23_监护仪 |
| 法规视图 | 按注册国家 | /30_Reg_Submission/EU_MDR |
| 过程视图 | 研发→验证→注册→上市后 | /23_DHF/→/50_PostMarket/ |
二、**层目录树(标准化结构,复制即用)
├─ 01_术语编码(GMDN/EMDN/Product Code)
├─ 02_法规与标准库(FDA/MDR/NMPA最新版本)
├─ 03_模板与母版(SOP/WI/表单/矩阵)
└─ 04_资质与授权(认证证书/NDA样板)
/10_QMS_体系与文控
├─ 11_SOP_程序文件
├─ 12_WI_作业指导
├─ 13_FRM_记录表单
└─ 14_Document_Control(编号规则)
/20_Product_产品主档(每个产品独立)
├─ 21_Definition_IFU(预期用途/禁忌症)
├─ 22_Risk_Management(ISO 14971)
├─ 23_DHF(设计历史文件)
├─ 24_Software_LifeCycle(IEC 62304)
├─ 25_Verification_Validation(测试报告)
├─ 26_Biocomp_Sterile_Pack(生物相容/灭菌)
├─ 27_Electrical_EMC(60601系列)
├─ 28_Materials_Chemical(材料化学)
├─ 29_Label_UDI_IFU(标签管理)
└─ 2A_Traceability_Matrix(追溯矩阵)
/30_Reg_Submission_注册申报
├─ FDA_510k_eSTAR
├─ EU_MDR_TechDoc(含GSPR矩阵)
├─ UK_MHRA_UKCA
├─ AU_TGA_ARTG
└─ CN_NMPA(中国注册)
/40_Clinical_Performance_临床性能
├─ 临床评价(CEP/CER)
├─ IVD性能研究
└─ 合规
/50_PostMarket_上市后
├─ PMS计划/报告
├─ PMCF计划/报告
├─ 警戒/召回
└─ 投诉趋势分析
/60_Supply_Chain_供应链
├─ 供方评估名录
├─ 外包质量协议
└─ COC/COA样板
/70_Change_CAPA_变更改进
├─ 变更控制(设计/工艺)
├─ CAPA/不合格项
└─ 风险再评估
/90_Export_Packs_对外快取包
├─ 机构审查包
├─ 客户售前包
└─ 电商平台包
三、命名、版本与元数据规范
命名规则
[域]-[国家]-[产品代号]-[类型]-[要素]-[版本]-[日期]-[语言]-[密级]
示例:REG-EU_MDR-P23-GSPR_Matrix-RevB-20250820-EN-INT.xlsx
版本控制
格式:MAJOR.MINOR.PATCH(如Rev1.2.3)
要求:每次变更需记录摘要+影响评估(是否触发再验证)
元数据字段(必填)
| 字段 | 示例 | 作用 |
|---|---|---|
| 文件所有者 | RA-Li@ | 责任人追溯 |
| 适用法规版本 | MDR 2017/745 | 合规性关联 |
| 申报章节映射 | eSTAR Section 5 | 快速检索 |
| 保密等级 | INT(内部) | 控制分发范围 |
| 下一次复审日 | 2026-08-20 | 自动提醒 |
四、合规映射索引与四向追溯
1. 单页映射索引表示例(Excel)
| 区域/路径 | 章节/条款 | 证据文件路径 | 版本 | 责任人 | 复审日 |
|---|---|---|---|---|---|
| EU/MDR | Annex I GSPR 1 | /20/P23/22_Risk/Matrix_RevB.xlsx | RevB | RA Lead | 2026-08-20 |
| FDA/510(k) | eSTAR: Indications | /20/P23/21_IFU/IFU_RevC.pdf | RevC | PM | 2026-02-01 |
2. 四向追溯矩阵
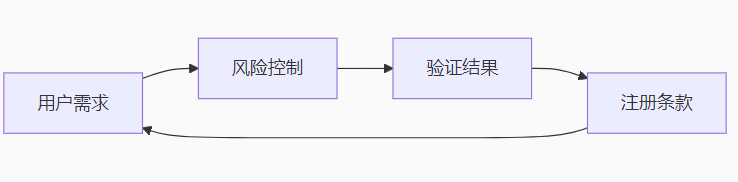
五、角色与权限管理(RACI)
| 角色 | 权限 | 操作范围 |
|---|---|---|
| Admin(文控) | 全权限 | 所有目录 |
| RA Lead | 编辑+审批 | /30_Reg_Submission/ |
| Engineer | 编辑 | /20_Product/对应产品 |
| ReadOnly | 只读+水印 | /90_Export_Packs/ |
工具推荐:SharePoint+权限组(低成本启动)
六、两周上线计划(MVP最小可行产品)
| 时间 | 任务 | 交付物 |
|---|---|---|
| Day 1-3 | 创建目录树+命名规则 | **层结构+权限设置 |
| Day 4-7 | 导入模板库+法规标准 | 02_法规与标准库/03_模板与母版 |
| Day 8-10 | 完成1个产品主档 | IFU+风险文件+关键测试报告 |
| Day 11-14 | 生成GSPR矩阵+eSTAR清单 | 映射索引表+对外快取包 |
七、SPICA角宿团队合规支持服务
1. 母版库快速搭建
现状诊断:识别资料缺口与重复项(输出差距报告)
体系部署:提供标准化目录模板+命名规则工具
数据迁移:协助历史文件归类与元数据补全
2. 合规内容赋能
模板库提供:
培训服务:RA/QA团队母版库使用培训
3. 持续优化服务
审计模拟:模拟FDA/MDR审计的文件检索挑战
KPI监控:
结语:让合规从成本变为价值
一套优秀的母版库不仅能降低审计风险(减少483警告信或MDR不符合项),更能提升注册效率(新产品注册周期平均缩短30%)。通过标准化、模块化、可追溯的体系,企业可将合规能力转化为市场竞争优势。
SPICA角宿团队提供母版库建设全周期支持:
🚀 两周快速上线:完成从0到1的体系搭建
📦 模板工具箱:提供GSPR矩阵、追溯表等即用模板
🔍 审计预演:模拟FDA/TÜV等机构文件检索路径
bys0613.b2b168.com/m/