如何申请免除2026财年FDA医疗器械企业年费?
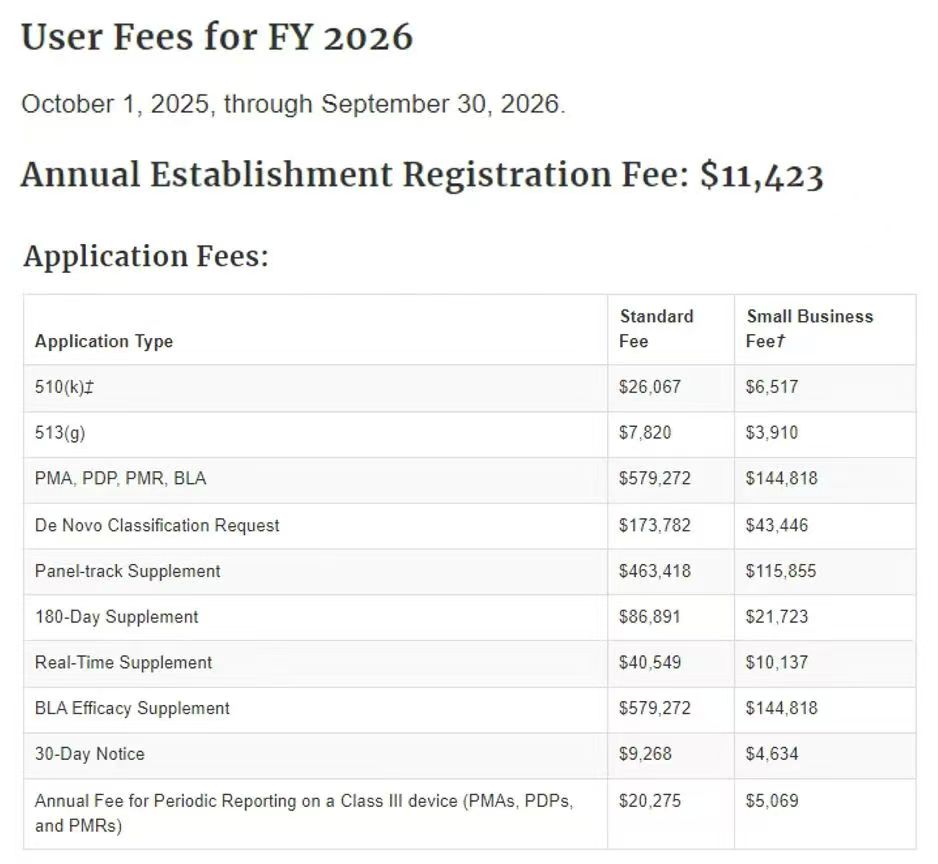
一、政策核心:来源与关键信息梳理
| 政策文件 | 发布时间 | 核心关键信息 |
|---|---|---|
| 《Medical Device User Fee Rates for FY 2026》(90 FR 35895) | 2025-07-30 | 1. 建立注册费标准:11,423 美元; 2. 豁免适用场景:仅 “续年度注册” 的符合条件小企业; 3. 法律依据:FD&C Act §738 (a)(3)(B)(ii)(II)。 |
| 《Medical Device User Fee Small Business Qualification and Determination Guidance》(最终版) | 2025-07-31 | 1. 豁免专属营收阈值:最近一纳税年度**营收(含关联方)≤100 万美元; 2. “财务困难(Financial Hardship)” 唯一量化标准:企业处于 “正在进行的破产程序”; 3. 申请材料核心:税务文件、破产证明、既往注册费缴费凭证。 |
| FDA MDUFA 官方页 | 2025 年 7 月更新 | FY 2026 小企业注册费豁免政策摘要,含申请通道入口与常见问题解答。 |
二、申请资格:四大 “一票否决” 前提条件
企业及全部关联方最近一纳税年度总营收≤1 亿美元(100M USD);
需通过 FDA CDRH Portal 提交 SBR(小企业资格申请):美国本土企业提交 Form 3602,境外企业提交 Form 3602A + 所在国税务机关英文认证,并获得 “Small Business Decision Number”。
企业及关联方最近一纳税年度**营收≤100 万美元(1M USD),需提供经税务机关认证的营收证明。
仅 “续年度注册” 企业可申请,**注册年度不得豁免(需提供既往任一年度注册费缴费凭证,如汇款回执、FDA Payment Receipt)。
FDA 目前唯一公开认可的量化标准为 “企业处于正在进行的破产程序”,需提供法院受理通知、审理中证明(需翻译 + 公证)。
三、关键时间线:倒排管理,避免逾期
| 阶段 | 建议完成时间 | 关键动作 |
|---|---|---|
| 资料准备 | 2025-07 | 1. 汇总 2024/2025 年企业及关联方纳税申报表,确认营收是否≤100 万美元; 2. 境外企业启动 “国家税务机关英文认证” 申请(需官方盖章); 3. 整理破产程序相关文件(法院通知、案件号等)。 |
| 提交 SBD 申请 | 最晚 2025-08-01 | 1. 通过 FDA CDRH Portal 提交 SBR(Form 3602/3602A); 2. 上传签字版报税表及关联方证明; 3. 等待 FDA 邮件确认,获取 “Small Business Decision Number”(约 2-4 周)。 |
| 提交豁免请求 | 最晚 2025-09-01 | 1. 需在 SBD 获批后≥60 天、注册费缴费截止前提交; 2. 通过 CDRH Portal 或邮件(userfees@fda.gov)提交流程包; 3. 记录提交 ID,用于后续跟进。 |
| FDA 审核与跟进 | 2025-09-01 至 10-31 | 1. 提交后 30 天邮件跟进(userfees@fda.gov); 2. 若 2025-12-31 前未获批,需预留时间缴纳 11,423 美元,避免违规。 |
| FY 2026 生效 | 2025-10-01 | 1. 豁免获批:免缴注册费; 2. 未获批:需在 2025-12-31 前完成缴费。 |
四、Step-by-Step 申请流程:从 SBD 到豁免请求
1. 小企业资格(SBD)申请流程
注册 / 确认 Org ID:登录 FDA User Fee System,完成企业 Org ID 注册或确认(需与注册信息一致)。
在线填写 SBR:
美国本土企业:选择 “MDUFA SBR”,填写 Form 3602;
境外企业:选择 “Foreign SBR”,填写 Form 3602A,并上传 “国家税务机关英文认证”(需含汇率、官方印章)。
上传佐证材料:最近一纳税年度签字版完整报税表、全部关联方报税表 / 营收证明。
获取 Decision Number:提交后等待 FDA 邮件确认(约 2-4 周),收到含 “Small Business Decision Number” 的 Decision Letter。
2. 注册费豁免(Financial Hardship Waiver)申请流程
准备封面信(推荐使用 FDA 模板):
引用法律依据:FD&C Act §738 (a)(3)(B)(ii)(II);
列明核心信息:Org ID、Owner/Operator ID、FY 2026 Small Business Decision Number;
说明 “财务困难”:明确企业处于破产程序,注明案件号,声明缴费将造成 Hardship。
整理核心附件(需完整且符合格式要求):
| 附件类别 | 具体文件 | 备注 |
|---|---|---|
| 破产证明 | 法院受理通知、正在审理证明 | 需原文 + 英文翻译(附宣誓翻译声明)、公证 |
| 营收证明 | 近一年纳税申报表 / 国家税务证明 | 需证明营收≤100 万美元,境外企业需英文认证 |
| 缴费证明 | 既往任一年度注册费付款凭证 | 如 FY 2025 Payment Receipt、银行汇款回执 |
| 企业信息 | 组织结构图、关联方列表 | 关联方需标注营收,确保无遗漏 |
| 声明文件 | 法定签字人声明 | 承诺材料真实性与完整性,引用 18 U.S.C.§1001 |
提交与跟进:
Portal 上传后保存 “Submission ID”;
提交后 3-4 周,通过电话(800-638-2041,FDA DICE 部门)或邮件跟进审核进度。
五、常见风险与应对策略
| 风险点 | 可能后果 | 预防 / 应对措施 |
|---|---|---|
| ** “SBD 获批后≥60 天” 提交时限 | FDA 直接不受理豁免请求,需全额缴费 | 1. 7 月启动资料准备,8 月 1 日前完成 SBD 申请; 2. 通过 Portal 提交时保留时间戳,作为提交凭证。 |
| 税务 / 破产文件翻译 / 盖章不合规 | 收到 FDA 补正通知(IR),延误审核 | 1. 选择具备 FDA 认可资质的翻译公司,附 “宣誓翻译声明”; 2. 境外企业提前与当地税务机关确认印章要求,确保英文认证有效。 |
| 未列全关联方,营收核算不准确 | 被判定 “信息不实”,撤销 SBD 资格 + 罚款 | 1. 梳理集团全部关联企业(含控股、参股公司); 2. 提交组织结构图,标注各关联方营收,确保总营收≤1 亿美元(SBD)及 100 万美元(豁免)。 |
| Portal 上传失败 / 无回应 | 审核延迟,**缴费截止日 | 1. 拆分大文件(单文件≤50MB),分批上传; 2. 上传后同步邮件发送至 userfees@fda.gov,附提交截图,双重备份。 |
| 中国企业破产程序无公开检索路径 | FDA 难以确认 “Active Bankruptcy” 状态 | 1. 提交法院裁定书、官方公告链接; 2. 附加法院联系方式及查询指南,方便 FDA 核实。 |
六、角宿团队:FY 2026 FDA 注册费豁免申请专业支持
1. 前期:资格评估与政策适配
双阈值验证:协助企业梳理**营收(含关联方),确认是否满足 “≤1 亿美元(SBD)”“≤100 万美元(豁免)” 双标准;
破产材料评估:审核破产文件(法院通知、审理证明)的完整性与合规性,指导补充公证、翻译材料,确保符合 FDA “Financial Hardship” 认定标准;
风险预判:若企业未进入破产程序,协助与财务 / 法律顾问评估 FDA 未来可能认可的其他 Hardship 标准,同时做好 “豁免未获批即缴费” 的预案。
2. 中期:材料编制与流程推进
SBD 申请支持:
协助填写 Form 3602/3602A,确保 Org ID、营收数据等信息与企业注册信息一致;
指导境外企业获取 “国家税务机关英文认证”,审核翻译件与原件的一致性;
豁免流程包编制:
按 FDA 模板撰写封面信,精准引用法条,明确核心信息;
审核附件完整性(如缴费凭证的有效性、关联方列表的全面性),规避 “材料缺失” 风险;
提交操作指导:协助通过 CDRH Portal 上传文件,记录 Submission ID,确保提交成功。
3. 后期:审核跟进与应急响应
进度跟踪:按 “30 天邮件跟进、4 周电话确认” 的节奏,与 FDA DICE 部门沟通审核进度,及时反馈企业;
补正响应:若收到 FDA 补正通知(IR),快速分析需求,协助补充材料(如补充关联方营收证明、完善破产程序说明);
应急方案:若豁免未获批,协助企业通过 FDA User Fee System 完成 11,423 美元注册费缴纳,避免逾期违规。
bys0613.b2b168.com/m/